|
|
燃料電池とは
燃料電池の概念を示します。燃料電池は水素と酸素の化学反応により水を生成する過程で電気を取り出す発電機です。
一般的には、水に電気を流して水素と酸素を生成するという、いわゆる<水の電気分解> の逆反応といわれています。
乾電池との違いは、乾電池は発電のための燃料をその本体の中に蓄えており、燃料の化学反応が終了した時点で
発電は停止することになります。 一方燃料電池の場合は燃料を外部から供給し、発電時に生成された水は外に排出
します。 燃料を供給し続ける限り、連続的に発電します。言い換えると、乾電池は電気の貯蔵庫であり、燃料電池は
電気の製造所つまり発電機といえます。
|
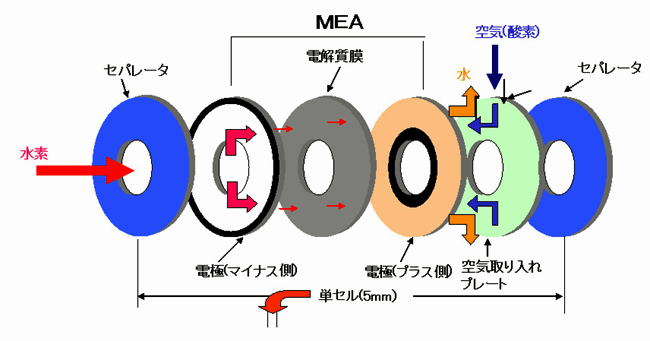
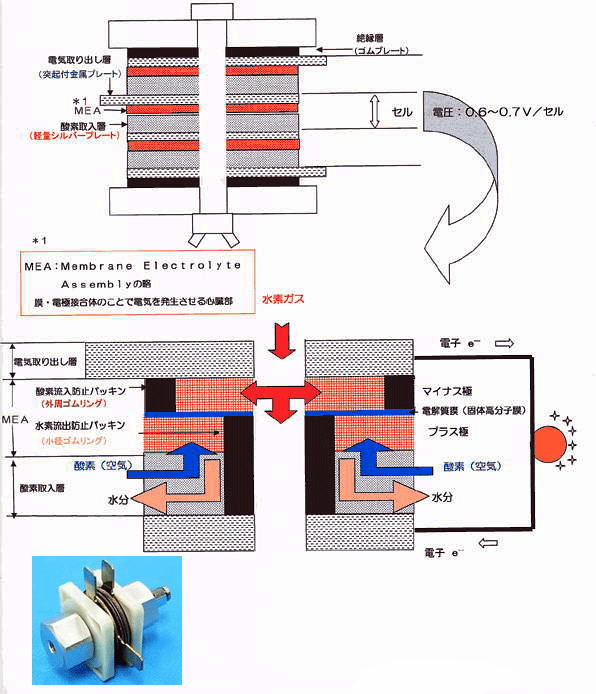
MEAのしくみ
燃料電池を説明する場合最も重要なキーワードがMEAと言われるものです。 このMEAの概念図を示します。
まず水素極に、燃料となる水素が供給されると、水素イオンと電子に分解されます。(⇒ H2→2H++2e-)
この反応は水素から電子を放出するので酸化反応です。
水素イオンはPEM(固体高分子膜)中を通って酸素極に達します。
また、電子はPEM中を通る事ができないので外部回路を通り仕事(発電)をした後、酸素極に達します。
一方酸素極では供給された酸素(空気)と、PEMを通ってきた水素イオンと、外部回路からきた電子が反応して
水が生成されます。
(⇒4H++O2+4e-→2H2O)この反応は、酸素が電子を受け取るので還元反応です。
このように水素極と酸素極で、酸化反応と還元反応を別々に行うことで電気を取り出しています。
このMEAを中心とした発電の最小単位をセルと呼びます。一つのセル電圧は理論上は約1.23Vですが、
実用上はセルの面積の大小に関わらず、0.6〜0.8Vとなります。電流についてはセルの面積に比例しています。
例えば、乾電池は単一と単三は一個ではどちらも1.5Vですが電流は大きい単一の方が多くの電流を流すことができます。
燃料電池も乾電池と全く同じ考え方ができます。
よってセルを複数個繋げてスタックにする事で高い電圧を取り出すことができるのです。
ちなみに、自動車や家庭用燃料電池にはセルが数十枚から数百枚のスタックを使用しています。
|
電流電圧(IV)特性について
電流電圧(IV)特性とは、燃料電池の性能評価に欠かせない、基本的な性能評価の1つです。
燃料電池から得られた電圧と電流を、各々縦軸と横軸にしてグラフに示す事で電流電圧特性を表します。
(通常IV特性と呼びます。)
図より、電流値が増加するに従って、電圧値は低下していきます。
この理由としては、燃料電池内部には様々な抵抗があり、
電流値が高くなるにつれて、内部抵抗が増えていきます。
その結果、電圧が低下するのです。 ちなみに、電池内部抵抗により電圧が低下していく現象を「分極」と呼びます。
|
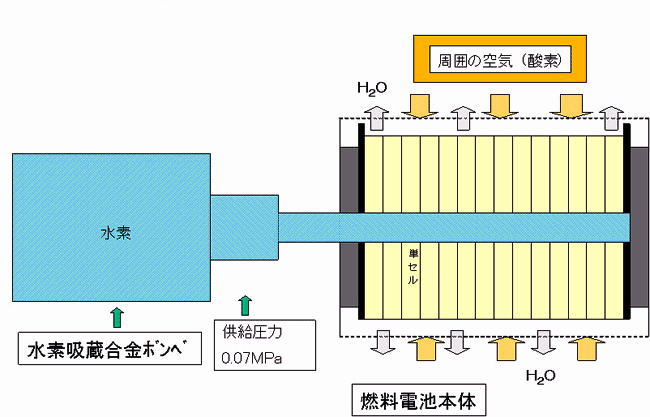
水素吸蔵合金のしくみ
水素吸蔵合金とは、加圧したり減圧したりする事で、水素ガスを吸蔵したり放出したりする特性を持つ合金を言います。
吸蔵時には、平衡圧力よりも高い水素圧力にするか、雰囲気温度を低くし、逆に放出時には、平衡圧力よりも
低い水素圧力にするか、雰囲気温度を高くします。
圧力、温度を変えるだけで水素ガスの吸蔵放出が行えるため、取り扱いが非常に容易であり、安全面にも優れています。
しかし一般的に、可能な水素吸蔵量が、合金質量の2〜3%ほどしかなく、また耐久性などの色々な問題も抱えています。
|
|

|
|

|

|
|
|
|
|
|
|
|